咨詢熱線
15201603266,15201507299,全國熱線:400-008-2003

河北省辦理醫(yī)用口罩產(chǎn)品注冊和生產(chǎn)許可資料
硬件要求:10萬級或以上的無塵車間進行生產(chǎn),并具備微生物試驗?zāi)芰拖嚓P(guān)理化試驗?zāi)芰Α旆?/span>
人員要求:未查詢到人員具體要求
文 件:建立質(zhì)量管理體系文件,包括質(zhì)量方針和質(zhì)量目標、質(zhì)量手冊、各種程序文件、技術(shù)文件和記錄
受理部門:河北省藥品監(jiān)督管理局
咨詢電話:0311-66635222(2號樓),0311-66635315
地 址:石家莊市新華區(qū)石清路9號河北省政務(wù)服務(wù)大廳2號樓市場開辦區(qū)綜合窗口 綜合受理窗口
產(chǎn)品注冊辦理流程(自受理之日起73個工作日)
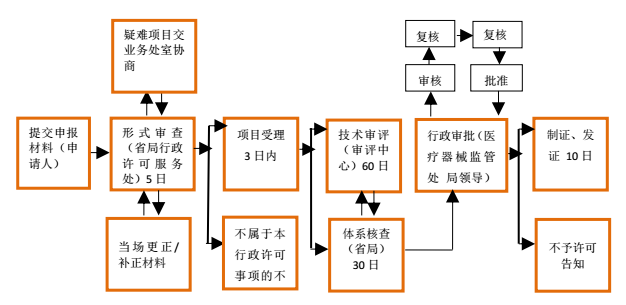
產(chǎn)品注冊提交材料:
|
材料名稱 |
填報須知 |
紙質(zhì)材料份數(shù) |
|
《醫(yī)療器械注冊申請表》 |
1、申報資料使用A4規(guī)格紙張打印,加蓋公章;2、復(fù)印件與原件一致;3、應(yīng)有所提交資料目錄,抽拉桿裝訂;4、除有明確Word文檔外,其他上傳均為PDF格式.下同 |
原件:1 |
|
證明性文件. |
申請人營業(yè)執(zhí)照副本 |
3 |
|
醫(yī)療器械安全有效基本要求清單 |
說明產(chǎn)品符合《醫(yī)療器械安全有效基本要求清單》(見申請表格及文件下載)各項適用要求所采用的方法,以及證明其符合性的文件,對于不適用的各項要求,應(yīng)當說明其理由。對于包含在產(chǎn)品注冊申報資料中的文件,應(yīng)當說明其在申報資料中的具體位置;對于未包含在產(chǎn)品注冊申報資料中的文件,應(yīng)當注明該證據(jù)文件名稱及其在質(zhì)量管理體系文件中的編號備查。 |
原件:1 |
|
綜述資料-有源無源 |
其他要求詳見示例樣表 |
原件:1 |
|
研究資料 |
其他要求詳見示例樣表。 |
原件:1 |
|
生產(chǎn)制造信息 |
6.1無源產(chǎn)品/有源產(chǎn)品生產(chǎn)過程信息描述 無源醫(yī)療器械:應(yīng)當明確產(chǎn)品生產(chǎn)加工工藝,注明關(guān)鍵工藝和特殊工藝,并說明其過程控制點。明確生產(chǎn)過程中各種加工助劑的使用情況及對雜質(zhì)(如殘留單體、小分子殘留物等)的控制情況。 有源醫(yī)療器械:應(yīng)當明確產(chǎn)品生產(chǎn)工藝過程,可采用流程圖的形式,并說明其過程控制點。 注:部分有源醫(yī)療器械(例如:心臟起搏器及導(dǎo)線)應(yīng)當注意考慮采用“(六)生產(chǎn)制造信息”1.中關(guān)于生產(chǎn)過程信息的描述。 6.2生產(chǎn)場地:有多個研制、生產(chǎn)場地的,應(yīng)當概述每個研制、生產(chǎn)場地的實際情況。 |
原件:1 |
|
臨床評價資料-有源無源 |
1)對列入《免于進行臨床試驗醫(yī)療器械目錄》有關(guān)產(chǎn)品,注冊申請時提交臨床評價資料要求: ①提交申報產(chǎn)品相關(guān)信息與《目錄》所述內(nèi)容的比對資料; ②提交申報產(chǎn)品與《目錄》中境內(nèi)已上市同品種醫(yī)療器械的比對說明,比對說明應(yīng)當包括《申報產(chǎn)品與目錄內(nèi)境內(nèi)已上市同品種醫(yī)療器械比對表》(見附件)和相應(yīng)支持性資料。 提交的上述資料應(yīng)能證明申報產(chǎn)品與《目錄》所述的產(chǎn)品具有等同性。 2)通過同品種醫(yī)療器械的對比進行臨床評價的產(chǎn)品,申請人應(yīng)按照《醫(yī)療器械注冊管理辦法》的相關(guān)規(guī)定提交臨床評價資料。 3)進行臨床試驗的產(chǎn)品,申請人應(yīng)當提交臨床試驗協(xié)議、倫理委員會批件、臨床試驗方案和臨床試驗報告。 |
原件:1 |
|
產(chǎn)品風(fēng)險分析資料-有源無源 |
產(chǎn)品風(fēng)險分析資料是對產(chǎn)品的風(fēng)險管理過程及其評審的結(jié)果予以記錄所形成的資料。應(yīng)當提供對于每項已判定危害的下列各個過程的可追溯性: 1)風(fēng)險分析:包括醫(yī)療器械適用范圍和與安全性有關(guān)特征的判定、危害的判定、估計每個危害處境的風(fēng)險。 2)風(fēng)險評價:對于每個已判定的危害處境,評價和決定是否需要降低風(fēng)險。 3)風(fēng)險控制措施的實施和驗證結(jié)果,必要時應(yīng)當引用檢測和評價性報告,如醫(yī)用電氣安全、生物學(xué)評價等。 4)任何一個或多個剩余風(fēng)險的可接受性評定。 |
原件:1 |
|
產(chǎn)品技術(shù)要求 |
申請人應(yīng)當在原材料質(zhì)量和生產(chǎn)工藝穩(wěn)定的前提下,根據(jù)申請人產(chǎn)品研制、前期臨床評價等結(jié)果,依據(jù)國家標準、行業(yè)標準及有關(guān)文獻,按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》的有關(guān)要求,編寫產(chǎn)品技術(shù)要求,內(nèi)容主要包含產(chǎn)品性能指標和檢驗方法。產(chǎn)品技術(shù)要求一式兩份,并提交兩份產(chǎn)品技術(shù)要求文本完全一致的聲明。 |
1 |
|
產(chǎn)品注冊檢驗報告/委托檢驗報告(注冊指定檢驗通知單-如有) |
提供具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具的注冊檢驗報告/委托檢驗報告和預(yù)評價意見(注冊指定檢驗通知單-如有)。醫(yī)療器械產(chǎn)品注冊檢驗時,待檢產(chǎn)品不在任何一家經(jīng)資質(zhì)認定的醫(yī)療器械檢驗機構(gòu)承檢范圍內(nèi),應(yīng)先申請指定檢驗,并將指定檢驗通知書和報告一并提交。 |
原件:1 |
|
說明書和標簽樣稿 |
提供具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具的注冊檢驗報告和預(yù)評價意見。醫(yī)療器械產(chǎn)品注冊檢驗時,待檢產(chǎn)品不在任何一家經(jīng)資質(zhì)認定的醫(yī)療器械檢驗機構(gòu)承檢范圍內(nèi),應(yīng)先申請指定檢驗,并將指定檢驗通知書和報告一并提交。 |
原件:1 |
|
符合性聲明-有源無源 |
1)申請人聲明本產(chǎn)品符合《醫(yī)療器械注冊管理辦法》和相關(guān)法規(guī)的要求;聲明本產(chǎn)品符合《醫(yī)療器械分類規(guī)則》有關(guān)分類的要求;聲明本產(chǎn)品符合現(xiàn)行國家標準、行業(yè)標準,并提供符合標準的清單。 2)所提交資料真實性的自我保證聲明(由申請人出具)。 |
1 |
|
《授權(quán)委托書》和《行政許可申請書》(非必須項) |
凡申請企業(yè)申報材料時,辦理人員不是法定代表人或企業(yè)負責(zé)人本人的提交《授權(quán)委托書》和《行政許可申請書》 |
原件:1 |
醫(yī)療器械生產(chǎn)許可(自受理之日起,20個工作日內(nèi)作出行政許可決定。)
|
材料名稱 |
填報須知 |
紙質(zhì)材料份數(shù) |
|
河北省藥品、醫(yī)療器械、化妝品申請行政審批承諾書 |
申請單位加蓋公章后掃描上傳文本(PDF),電子文本清晰,不需提供紙質(zhì)資料 |
1 |
|
《授權(quán)委托書》(非必須項) |
凡申請企業(yè)申報材料時,辦理人員不是法定代表人或負責(zé)人本人的提交《授權(quán)委托書》。 |
原件:1 |
|
核發(fā)《醫(yī)療器械生產(chǎn)許可證》申請書 |
簽字蓋章 |
原件:1 |
|
《醫(yī)療器械生產(chǎn)許可申請表》 |
1、從國家藥品監(jiān)督管理局網(wǎng)站登陸國家藥品監(jiān)督管理局官方網(wǎng)站(http://www.nmpa.gov.cn)“網(wǎng)上辦事”欄目中的“醫(yī)療器械生產(chǎn)經(jīng)營許可備案信息系統(tǒng)”按要求填寫后打印并保存。要法定代表人簽字及公司蓋章。 2、填寫的企業(yè)名稱、法定代表人、住所等信息應(yīng)與營業(yè)執(zhí)照相應(yīng)信息一致。 3、填寫的醫(yī)療器械產(chǎn)品名稱,規(guī)格,有效期等信息與國家藥品監(jiān)督管理局或河北省藥品監(jiān)督管理局核發(fā)的《中華人民共和國醫(yī)療器械注冊證》批件上相應(yīng)信息一致。 |
1 |
|
證明性文件. |
申請人營業(yè)執(zhí)照副本 |
2 |
|
醫(yī)療器械注冊證及其附件復(fù)印件、歷次醫(yī)療器械注冊變更文件 |
申請企業(yè)持有的申請生產(chǎn)的《醫(yī)療器械注冊證》及其附件(加蓋注冊專用章的技術(shù)要求和說明書)的復(fù)印件、以及有效期內(nèi)歷次醫(yī)療器械注冊變更文件復(fù)印件 |
原件:0 |
|
法定代表人、企業(yè)負責(zé)人身份證明復(fù)印件,企業(yè)負責(zé)人的任職文件復(fù)印件 |
使用A4規(guī)格紙張打(復(fù))印,加蓋單位公章;電子文檔(PDF格式)清晰完整;任職文件中,職務(wù)必須明確,不可直接任命為“企業(yè)負責(zé)人” |
1 |
|
生產(chǎn)、質(zhì)量和技術(shù)負責(zé)人的身份、學(xué)歷、職稱證明復(fù)印件 |
生產(chǎn)、質(zhì)量和技術(shù),生產(chǎn)和質(zhì)量不可為同一人 |
1 |
|
生產(chǎn)管理、質(zhì)量檢驗崗位從業(yè)人員學(xué)歷、職稱一覽表 |
生產(chǎn)管理人員要標明部門、崗位、學(xué)歷、職稱,質(zhì)量檢驗人員要與申請表填寫一致 |
1 |
|
生產(chǎn)場地的證明文件,有特殊生產(chǎn)環(huán)境要求的還應(yīng)當提交設(shè)施、環(huán)境的證明文件 |
生產(chǎn)場地的證明文件(規(guī)劃用途或設(shè)計用途不應(yīng)為“住宅”),包括房屋產(chǎn)權(quán)證明(或使用權(quán)證明)或租賃協(xié)議和被租方房屋產(chǎn)權(quán)證明(或使用權(quán)證明)復(fù)印件;廠區(qū)地理位置路線圖、廠區(qū)總平面圖(標明樓號、樓層和面積)、主要生產(chǎn)車間布置圖。有潔凈要求的車間,須標明功能間潔凈等級及人流、物流走向,同時提供潔凈室(含檢驗用室)的合格檢測報告復(fù)印件(檢測報告應(yīng)是由食品藥品監(jiān)督管理部門認可的檢測機構(gòu)出具的一年內(nèi)的符合《無菌醫(yī)療器具生產(chǎn)管理規(guī)范》(YY0033)的合格檢測報告) |
原件:1 |
|
醫(yī)療器械主要生產(chǎn)設(shè)備和檢驗設(shè)備目錄 |
統(tǒng)計完整 |
1 |
|
質(zhì)量手冊和程序文件目錄 |
質(zhì)量手冊目錄和程序文件目錄 |
1 |
|
工藝流程圖 |
需注明主要生產(chǎn)方式、外購?fù)鈪f(xié)件,主要控制項目和控制點,關(guān)鍵和特殊工序的設(shè)備、人員及工藝參數(shù)控制的說明 |
1 |
|
質(zhì)量體系核查報告及聲明 |
近一年內(nèi)企業(yè)生產(chǎn)質(zhì)量管理體系合格報告,自我保證聲明:聲明一年內(nèi)企業(yè)已通過產(chǎn)品首次注冊體系核查,且質(zhì)量管理體系沒有變化。質(zhì)量體系變化的出具變化說明 |
1 |